Para lograr ese aval es preciso cumplir con los requerimientos establecidos en este país, los cuales están acordes a los estándares internacionales en cuanto a estudios preclínicos, ensayos clínicos y los aspectos que avalan la calidad del producto, aseguró la máster en Ciencias Olga Lidia Jacobo, directora del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed).
En una información divulgada por el Ministerio de Salud Pública (Minsap), la especialista precisó que dicho estatus regulatorio posibilita el uso masivo del inmunógeno (ya como vacuna oficialmente) en el territorio nacional, y su comercialización a otras naciones mientras se mantenga la emergencia sanitaria.
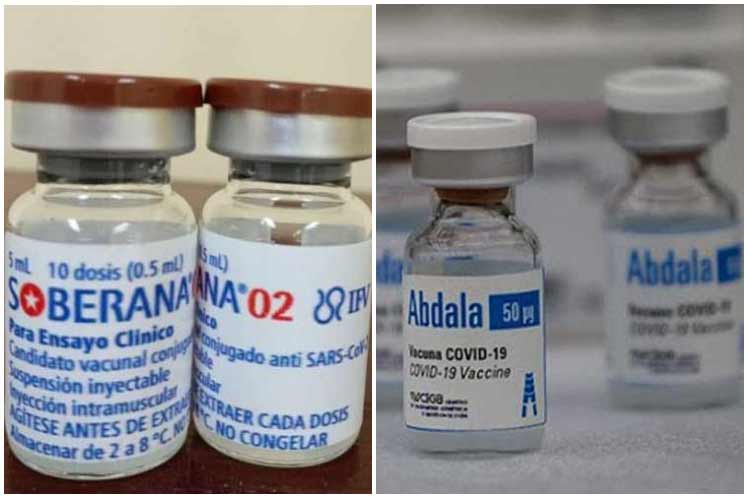
En la actualidad el Cecmed analiza el expediente del inyectable desarrollado por el Centro de Ingeniería Genética y Biotecnología (CIGB) y realiza la inspección al proceso productivo, para lo cual se comprueba la elaboración del fármaco en esa institución líder del candidato y los Laboratorios Aica, con vistas a avalar el cumplimiento de las Buenas Prácticas de Fabricación.
Por otro lado, se prevé que próximamente el Instituto Finlay de Vacunas (IFV) presente la documentación requerida para optar por esa posibilidad con el candidato vacunal Soberana 02, el cual ya concluyó también la tercera fase de ensayos clínicos.
Recientemente se conoció que tanto Abdala como Soberana 02, ya sobrepasaron el límite de eficacia (50 por ciento) establecido por la Organización Mundial de la Salud (OMS) para ser consideradas vacunas.
La primera evidenció un 92,28 por ciento en su esquema de tres dosis, mientras que la segunda mostró un 62 por ciento con solo dos dosis. De esta última falta por demostrar la eficacia en su fórmula de tres inyecciones, en la cual, la tercera es una de Soberana Plus, también diseñada por el IFV.
Según aclaró el director de esa institución, Vicente Vérez, se espera que los resultados de este último esquema ronden entre el 85 y 95 por ciento de eficacia, lo cual se sabrá en los próximos días.
Con el autorizo de uso de emergencia los fabricantes de las vacunas contra la Covid-19 pueden solicitar a la OMS el proceso de revisión, que se realiza a través de la evaluación de expertos internacionales.
La Organización Panamericana de la Salud (OPS) indicó que cada país tiene la decisión soberana de utilizar cualquier vacuna.
En varias ocasiones, el organismo sanitario regional ha reconocido los esfuerzos de Cuba en el desarrollo de candidatos vacunales antiCovid-19 propios y su importancia para la región pues permite disminuir la vulnerabilidad de sus países frente a la pandemia.
mem/rbp