El anuncio se produce semanas después de que la FDA emitiera un aviso sobre la poca seguridad del fármaco contra la subvariante Ómicrón XBB.1.5, responsable del 61 por ciento de los casos en el país, según datos federales recientes.
“La acción de hoy para limitar el uso de Evusheld evita exponer a los pacientes a posibles efectos secundarios como reacciones alérgicas, que pueden ser potencialmente graves”, afirmó la FDA en un comunicado.
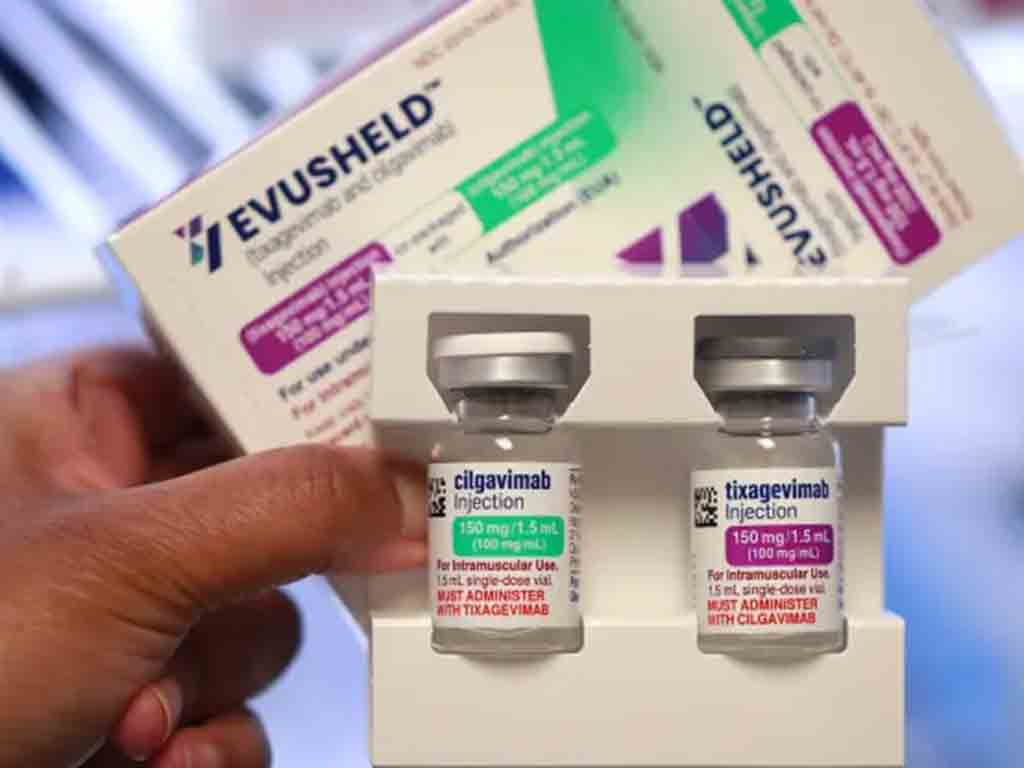
Evusheld es una combinación de dos anticuerpos monoclonales, cuyo uso se autorizó en personas con inmunodepresión moderada o grave y que probablemente no habrían desarrollado una respuesta inmunitaria fuerte a las vacunas contra el SARS-CoV-2.
Según un contacto de prensa del productor de Evusheld AstraZeneca, los datos de laboratorio demuestran que el tratamiento es ineficaz contra muchas subvariantes de omicron, incluidas las tres principales que circulan en los Estados Unidos: XBB.1.5, BQ.1.1 y BQ.1.
La constante mutación del coronavirus deja obsoletos otros tratamientos similares, como el bebtelovimab que se le detuvo la autorización en noviembre pasado, de acuerdo con la agencia de salud.
Sin embargo, las instalaciones que tienen Evusheld en existencia deben conservar lo que tienen en lugar de desechar los medicamentos, aconsejó la FDA, ya que otras cepas susceptibles al tratamiento pueden volverse frecuentes en el futuro.
rgh/adr